مقاله مروری با عنوان "چالشهای بررسی همارزی درمانی داروهای موضعی موثر در دستگاه گوارش" در مجله Pharmaceutics در سال 2025 منتشر شده است. برای داروهای سیستمیک، سطح خونی شاخص مناسبی برای همارزی زیستی است؛ اما برای داروهای موضعی موثر در دستگاه گوارش مانند ریفاکسیمین (یک آنتیبیوتیک با جذب ناچیز)، غلظت پلاسمایی منعکسکننده اثر موضعی نیست و روشهای استاندارد ناکافیاند. این مقاله به بررسی دشواریهای ارزیابی همارزی زیستی و درمانی داروهایی میپردازد که در دستگاه گوارش عمل میکنند و جذب سیستمیک کمی دارند. بخشی از این مقاله به دیدگاههای مقرراتی FDA و EMA در خصوص هم ارزی درمانی این داروها پرداخته می شود که در ادامه آورده شده است.
FDA و EMA هر دو مسیرهای مختلفی برای نشان دادن همارزی پیشنهاد میکنند:
دیدگاههای مقرارتی FDA:
توصیههای هم ارزی زیستی، بهصورت اختصاصی برای هر دارو صادر میشوند و بر اساس توانایی، حساسیت و تکرارپذیری روشها برای مقایسه میزان و سرعت تحویل ماده مؤثره در محل اثر، تنظیم شدهاند. سازمان FDA بهطور مستمر راهنماهای خاص برای هر محصول را منتشر میکند که بیانگر دیدگاه و انتظارات این سازمان در مورد توسعه محصولات درمانی معادل با داروهای مرجع است. این موارد شامل انواع مختلف محصولات هستند: عوامل بایندینگ، فرآوردههای با رهش فوری و کنترلشده، داروهایی با جذب سیستمیک متفاوت و قطعیتهای گوناگون در پیشبینی رفتار درون تن براساس دادههای برون تن و همچنین مواد مؤثره دارویی با حلالیت و نفوذپذیری متفاوت.
نمونه هایی از راهنماهای اختصاصی FDA در ادامه آورده شده است:
نمونه اول: عوامل بایندینگ مانند Sevelamer Carbonate و Lanthanum Carbonate که با اتصال به فسفات غذایی در روده مانع جذب آن میشوند، جذب سیستمیک حداقلی دارند. بنابراین، غلظت پلاسمایی آنها شاخص مناسبی برای اثر دارو نیست. در مقابل، تعادل و سرعت بایندینگ فسفات را میتوان با روشهای آزمایشگاهی (برون تن) معتبر و کمی اندازهگیری کرد. به همین دلیل، FDA مطالعه برون تن را بهعنوان گزینهای دقیقتر، کارآمدتر و اخلاقیتر نسبت به مطالعات بالینی یا فارماکودینامیک پیشنهاد میدهد.
نمونه دوم: داروی Orlistat که مهارکننده لیپاز رودهای بوده و در درمان چاقی استفاده میشود، جذب سیستمیک حداقلی و حلالیت کمی دارد. بنابراین، دادههای برون تن (مثل حل شدن دارو) لزوماً مرتبط نیستند. ازاینرو FDA پیشنهاد میکند که درصد دفع چربی مدفوع بهعنوان شاخص فارماکودینامیک برای ارزیابی هم ارزی زیستی بین فرآوردههای مختلف با محصول مرجع استفاده شود، زیرا این شاخص قابل دسترس و قابل اعتماد است.
دیدگاههای مقرارتی EMA:
EMA در سال 2019 یک دستورالعمل جامع با عنوان
Guideline on equivalence studies for locally applied, locally acting products in the gastrointestinal tract
منتشر کرد که در این دستورالعمل تصریح میشود که:
آزمونهای جایگزین مانند برون تن غیرسنتی (مثل شبیهسازی در لوله آزمایش یا سیستمهای سلولی) و روشهای درونتن غیرسنتی غیرمرسوم) مثل مدلهای حیوانی خاص یا تکنیکهای تصویربرداری بیولوژیک جدید ) میتوانند از آزمونهای بالینی یا فارماکودینامیک سنتی (مطالعات بالینی کامل روی بیماران یا آزمونهای فارماکودینامیک کلاسیک مثل اندازهگیری مستقیم اثر دارو روی یک اندام یا مارکر بیولوژیک در بدن(، حساستر باشند.
این دستورالعمل به دنبال روشهایی است که بتوانند با دقت بیشتری تفاوتهای فرمولاسیونی را آشکار کنند، در حالی که از نظر هزینه و زمان نیز قابل مدیریت باشند .
EMA پیشنهاد میکند که انتخاب روش برای اثبات هم ارزی زیستی با رویکرد مرحلهای (Stepwise Approach) انجام شود.
رویکرد مرحلهای اثبات هم ارزی طبق دستورالعمل EMA:
مرحله ۱: بررسی ویژگیهای بیوفارماسیوتیکی و فارماکوکینتیکی دارو
شناخت کامل از رفتار دارو در دستگاه گوارش و جذب سیستمیک آن ضروری است. این مرحله تعیین میکند که آیا دادههای فارماکوکینتیک کافی برای اثبات همارزی درمانی وجود دارد یا نیاز به مطالعات بالینی است.
مرحله ۲: مطالعات فارماکوکینتیک
انجام دو مطالعه فارماکوکینتیک یکی در حالت ناشتا و دیگری همراه با غذا. غذا میتواند تأثیر زیادی بر انتشار و جذب دارو در روده داشته باشد. مطالعات فارماکوکینتیک باید شامل اندازهگیریهای دقیق غلظت دارو در محلهای جذب بالینی مهم باشد.
مرحله ۳: آنالیز Partial AUC ( مساحت زیر منحنی جزئی)
- برای داروهای با رهشتعدیلشده، مهم است که رفتار دارو در بخشهای مختلف روده (محلهای جذب بالینی کلیدی) متفاوت است.
- این کار به تعیین دقیق سرعت و میزان جذب دارو کمک میکند.
مرحله ۴: مطالعات بالینی با اندپوینت درمانی:
زمانی انجام میشود که دادههای PK کافی نباشند، یا جذب دارو اشباعپذیر (saturable) باشد. هدف، تعیین اثر واقعی درمانی دارو در بیماران است.
مرحله ۵: ابزارهای پیشبینی و مدلسازی
- مدلهای برونتن پیشرفته یا مدلسازی فارماکوکینتیک مبتنی بر فیزیولوژی میتوانند بهعنوان ابزار کمکی برای پیشبینی غلظت دارو در روده به کار روند.
- این ابزارها نقش کمکی دارند و جایگزین مطالعات بالینی یا فارماکوکینتیک نیستند.
درخت تصمیم پیشنهادی برای انتخاب روش مناسب جهت برآورد همارزی زیستی (BE) برای اشکال دارویی جامد که در روده اثر میکنند، در شکل زیر نشان داده شده است.
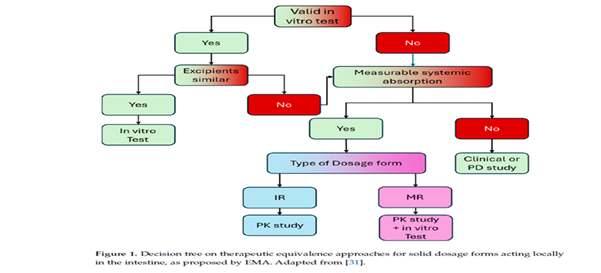
نتیجهگیری
طراحی روشهای نوین آزمایشگاهی و مدلسازی، به همراه انعطافپذیری و هماهنگی در دستورالعملهای مقرراتی بینالمللی، کلید موفقیت در عرضه ژنریکهای ایمن و مؤثر در این حوزه است. FDA برای داروهای با اثر موضعی در دستگاه گوارش دستورالعملهای اختصاصی ارائه میدهد. این توصیهها بهصورت موردی و بر اساس ویژگیهای دارو، جذب سیستمیک و قابلیت اندازهگیری اثر دارو طراحی شدهاندEMA .انعطافپذیری بیشتری نسبت به FDA دارد و به توسعهدهندگان دارو اجازه میدهد بسته به ویژگی دارو، مسیرهای مختلفی برای اثبات BE انتخاب کنند.
منبع:

نتیجهگیری
طراحی روشهای نوین آزمایشگاهی و مدلسازی، به همراه انعطافپذیری و هماهنگی در دستورالعملهای مقرراتی بینالمللی، کلید موفقیت در عرضه ژنریکهای ایمن و مؤثر در این حوزه است. FDA برای داروهای با اثر موضعی در دستگاه گوارش دستورالعملهای اختصاصی ارائه میدهد. این توصیهها بهصورت موردی و بر اساس ویژگیهای دارو، جذب سیستمیک و قابلیت اندازهگیری اثر دارو طراحی شدهاندEMA .انعطافپذیری بیشتری نسبت به FDA دارد و به توسعهدهندگان دارو اجازه میدهد بسته به ویژگی دارو، مسیرهای مختلفی برای اثبات BE انتخاب کنند.
منبع:
Tsakiridou G, Papanastasiou AM, Efentakis P, Angelerou MF, Kalantzi L. Challenges in the Investigation of Therapeutic Equivalence of Locally Applied/Locally Acting Drugs in the Gastrointestinal Tract: The Rifaximin Case. Pharmaceutics. 2025 Jun 27;17(7):839.
