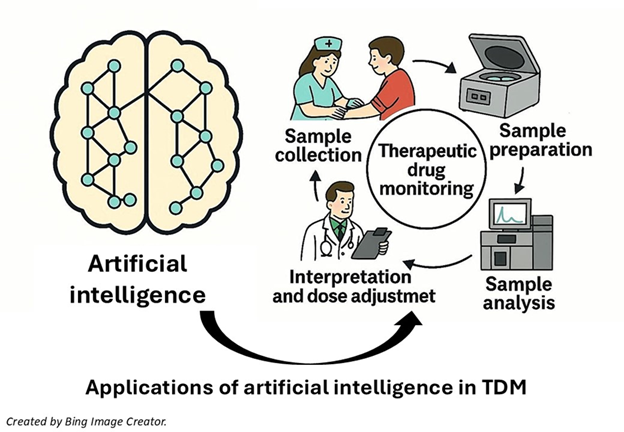
 پایش دارودرمانی (TDM) به یافتن ارتباط بین غلظت داروها در بدن و پیامد درمانی حاصل از آنها میپردازد و هدف اصلی آن بهینهسازی دوز داروها، برای دستیابی به اثرات درمانی مطلوب با حداقل عوارض جانبی است. تمرکز TDM بر داروهایی با شاخص درمانی (TI) باریک است؛ بنابر تعریف FDA شاخص درمانی باریک به داروهایی نسبت داده میشود که تغییرات جزئی در دوز یا غلظت خونی آنها میتواند منجر به عوارض جانبی تهدید کننده حیات یا شکست درمان شود. داروهای ضدصرع، سرکوب کننده ایمنی، لیتیم، دیگوکسین و برخی آنتیبیوتیکها از جمله این داروها هستند.
پایش دارودرمانی (TDM) به یافتن ارتباط بین غلظت داروها در بدن و پیامد درمانی حاصل از آنها میپردازد و هدف اصلی آن بهینهسازی دوز داروها، برای دستیابی به اثرات درمانی مطلوب با حداقل عوارض جانبی است. تمرکز TDM بر داروهایی با شاخص درمانی (TI) باریک است؛ بنابر تعریف FDA شاخص درمانی باریک به داروهایی نسبت داده میشود که تغییرات جزئی در دوز یا غلظت خونی آنها میتواند منجر به عوارض جانبی تهدید کننده حیات یا شکست درمان شود. داروهای ضدصرع، سرکوب کننده ایمنی، لیتیم، دیگوکسین و برخی آنتیبیوتیکها از جمله این داروها هستند.TDM از مدلهای فارماکوکینتیکی برای مدلسازی ارتباط بین غلظت و اثرات داروها بهره میگیرد. همگام با تکوین مدلهای سنتی فارماکوکینتیک، هوش مصنوعی به عنوان ابزاری نوین برای آنالیز دادههای حوزه سلامت مطرح شد. به طور کلی هوش مصنوعی، همانطور که از نامش پیداست، در پی شبیهسازی هوش انسانی است. یادگیری ماشین نیز به عنوان زیرمجموعهای از هوش مصنوعی، به توانایی ماشینها در یادگیری از دادهها و انجام پیشبینی اشاره دارد. تفاوت اصلی این دو روش را میتوان به این صورت تبیین کرد: مدلهای سنتی با تکیه بر دادههای فارماکوکینتیکی بهدنبال تخمینی قابل قبول از نظر فیزیولوژیکی و فارماکولوژیکی هستند؛ این در حالیست که تمرکز یادگیری ماشین صرفا بر کمینه کردن خطای آنالیز است.
یکی از کاربردهای هوش مصنوعی در پایش دارودرمانی پیشبینی غلظت داروها در بدن است که به علت محدودیت تعداد داوطلبان و دشواری فرآیند نمونهگیری امری چالش برانگیز بهشمار میآید. بهرهگیری از یادگیری ماشین میتواند سبب کاهش تعداد نمونههای مورد نیاز گردد. در مطالعهای صورت گرفته روی غلظت خونی تاکرولیموس و مایکوفنولیک اسید، از دادههای 3 زمان نمونهگیری برای آموزش مدلها استفاده شد. نتایج، حاکی از عملکرد بهتر الگوریتم XGBoost در مقایسه با مدلهای فارماکوکینتیکی بود. از طرفی، عملکرد مطلوب الگوریتمهای یادگیری ماشین وابسته به میزان دادههای در دسترس است؛ استفاده از دادههای شبیهسازی شده میتواند راهحلی برای این مشکل باشد. الگوریتمهای یادگیری ماشین برتری خود نسبت به روشهای سنتی در آنالیز دادههای شبیهسازی شده را نیز در مطالعات به نمایش گذاشتهاند.
از دیگر کاربردهای یادگیری ماشین میتوان به بهینهسازی دوز داروها اشاره کرد. در پژوهش انجام شده روی ونکومایسین، آنتیبیوتیکی با شاخص درمانی باریک، از روش یادگیری ماشین برای پیشبینی دوز دارو برای رسیدن به غلظت درمانی هدف استفاده شد. از پارامترهای وزن، شاخص توده بدنی (BMI) و نرخ تخمینی فیلتراسیون گلومرولی (eGFR) برای آموزش مدل بهره گرفته شد. نتایج نشانگر عملکرد بهتر روش یادگیری ماشین نسبت به روشهای سنتی در پیشبینی دوز مورد نیاز برای دست یابی به محدوده غلظتهای mg/L 10-5، mg/L 20-10 و mg/L 20≤ بود.
یادگیری ماشین همچنین میتوانند در ترکیب با مدلهای فارماکوکینتیکی در پایش دارودرمانی نقش ایفا کند. الگوریتمهای یادگیری ماشین میتوانند محققان را در انتخاب مدل فارماکوکینتیکی، تغییر پیشفرضهای مدلها و توسعه مدلهای فارماکوکینتیکی با مدلسازی پارامترهای اثرگذار بر نتیجه یاری کنند.
درکنار مزایای بیان شده، چالشهایی نیز در استفاده از یادگیری ماشین وجود دارد. نیاز به حجم داده بالا جهت آموزش مدلها (معمولا بیش از 1000 داده)، اطمینان از تعمیمپذیری نتایج بهدست آمده و مشکل تفسیرپذیری نتایج مدلهای پیچیده از جمله چالشهای موجود در بهرهگیری از یادگیری ماشین هستند. استفاده از دانش متخصصان حوزه فارماکوکینتیک برای درک نتایج مدلها و اطمینان از بهکارگیری صحیح هوش مصنوعی در مسئله پایش دارودرمانی میتواند راهحلی برای عبور از این مشکلات باشد.
برگرفته از:
Poweleit, E. A., Vinks, A. A., & Mizuno, T. (2023). Artificial Intelligence and Machine Learning Approaches to Facilitate Therapeutic Drug Management and Model-Informed Precision Dosing. Therapeutic drug monitoring, 45(2), 143–150.
Donnelly, M., Fang, L., Madabushi, R., Zhu, H., Luke, M., Canterbury, C., Lerman, B., Kaur, P., Patel, D., Sun, W., Schuirmann, D., Dinsmore, S., Mehta, M., & Zhao, L. (2025). Narrow Therapeutic Index Drugs: FDA Experience, Views, and Operations. Clinical pharmacology and therapeutics, 117(1), 116–129.
Donnelly, M., Fang, L., Madabushi, R., Zhu, H., Luke, M., Canterbury, C., Lerman, B., Kaur, P., Patel, D., Sun, W., Schuirmann, D., Dinsmore, S., Mehta, M., & Zhao, L. (2025). Narrow Therapeutic Index Drugs: FDA Experience, Views, and Operations. Clinical pharmacology and therapeutics, 117(1), 116–129.
